人类群体的性别比为什么不等于1?
https://pic1.zhimg.com/v2-eecbbd3acddabc90c39f05248b9c684e_720w.jpg?source=172ae18b
性别比(sex ratio)专门用于指代男性对女性的比例。
对于大部分生物,包括人类,性别比都是非常接近1的。这个比例乍看起来非常正常也容易理解——因为一个男性配对一个女性嘛。但是有很多物种并不是一夫一妻制(Monogamy),而大多是一夫多妻制(Polygamy),人类(在大部分的演化时间中)也不例外 (Dupanloup et al., 2003)。而且对于群体的生存,“1”其实并不是最“好”的性别比——为了达到群体最高的生育率和增长率,给定后代数量限额,更好的策略是生更多的女性和更少的男性,当然前提是要保证每个出生的女性都能有效地受精(男性不会忙不过来),而这时性别比应该会小于1。然而为什么演化没有选择这种策略而是选择了“1”作为大部分物种的性别比呢?
经过一些思考,不难想到这可能与一个简单的事实有关:后代总是由一个男性和一个女性共同贡献的。假如群体中性别比大于1(男性多于女性),因为男性和女性共享相同数量的后代,女性的平均适应度(fitness,这里仅由后代数量决定)将比男性的平均适应度高。因此,如果一个个体获得一个突变,这个突变使得这个个体更容易生下女性后代,那么他/他将会有更多的孙子或孙女,而这个突变也将受到正向选择,在群体中越来越常见,直到这个群体的性别比下降到1。Fisher在他的著作“The genetical theory of natural selection”中也提到了这个简单的想法 (Fisher, 1958),而之后的一些工作也提供了数学上的证明 (Eshel, 1975)。
“The genetical theory of natural selection”,演化生物学与群体遗传学圣经,但是似乎没有中译版
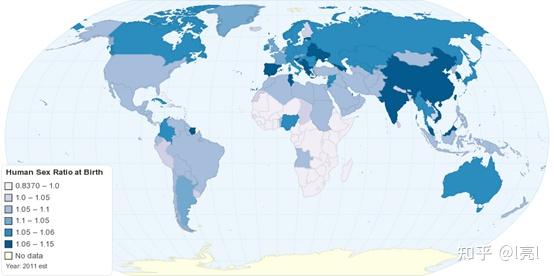
然而在人类群体中,出生性别比并不完全等于1,而是略微大于1,大约在1.05左右 (Austad, 2011; Jacobsen et al., 1999)。如果上文所说的逻辑没有问题,为什么自然选择没有导向一个严格等于1的性别比呢?我最初以为这个稍大的出生性别比是由比较高的男性死亡率造成的——出生时“故意”产生更多的男性,而男性更容易在成长过程中死亡 (Patton et al., 2009; Rajaratnam et al., 2010),因此性别比会在出生后的时间里逐渐地变低,并且在到达可生育年龄的时候正好下降到1左右,这就符合了之前提到的逻辑。然而又仔细想了想,这种解释其实行不通——按照这种解释,虽然男性和女性在到达可生育年龄时会有相同的适应度,但是在刚出生时,女性的适应度还是比男性高。因此,一个偏爱女性后代的突变还是会受到正向选择。实际上,如果我们不考虑养育子女的成本,那么自然选择将总是会将出生性别比调整为1,而男性或女性的死亡率以及可生育年龄时的性别比都对此没有影响。举一个例子,我们假设从出生到性成熟,男性有较高的死亡率。一方面,较高的死亡率降低了男性性成熟的可能();另一方面,这也导致了可生育年龄群体偏低的性别比,而这其实增加了已经性成熟男性的适应度(,是下一代新生儿总数,是该代新生男性总数)。而在计算平均男性适应度时这两种效应互相抵消了()。相同的方法也可以同样计算出女性平均适应度(,是该代新生女性总数)。可以注意到两性的平均适应度都与死亡率无关。如果男性适应度较高(),那么自然选择将导致越来越多的个体倾向于生男性后代,直到。可以看到,自然选择将平衡两性的适应度,总是将性别比不偏不倚地导向1()。
2011年性别比,http://chartsbin.com/view/2332。 2021年最新普查结果显示中国出生性别比为1.113
然而这还是无法解释为什么人类群体的出生性别比略微大于1。一篇PNAS论文对这一点提供了一些有用的信息 (Orzack et al., 2015)。这篇文章分析了人类从受孕到出生过程中的性别比,并且据此推测人类的性别比在受孕时应该就是1,而较高的出生性别比是由于孕期较高的女性胎儿自然流产率导致的。结合这个证据,似乎性别比的问题已经迎刃而解了——自然选择总会将受孕时的性别比调整为1,而出生性别比很大程度上是由孕期两性胎儿的死亡率决定的,并且根据前文的逻辑,孕期死亡率完全不会影响受孕时的性别比。
然而,还有一个重要的因素我们还没有考虑,那就是亲代投资(parental investment)——假如产下一男性后代对母子的生命有更大的风险,或者养育一个男性后代需要亲代提供更多的资源,那么产下女性后代将成为更好的选择,而这将导致一个小于1的性别比。Fisher也意识到了这一点,并且提出性别比是由两个性别各自的亲代投资(在书中Fisher 的用词是parental expenditure)决定的 (Fisher, 1958)。这个观点后来被称为 Fisher's principle,而后又被 Robert Trivers 更进一步地发展,并提出了亲代投资理论(parental investment theory)(Trivers, 1972; Trivers & Willard, 1973)。亲代投资的定义是“亲代对一个后代个体的行为,增加了这个后代的存活率,但代价是降低了亲代对其他后代投资的能力”("any investment by the parent in an individual offspring that increases the offspring's chance of surviving at the cost of the parent's ability to invest in other offspring.")。Fisher's principle大概的意思是,由于男性与女性对他们的后代的贡献是相同的,因此亲代对两性的总投资应该相等;如果不同性别的后代个体有不同的亲代投资需求,自然选择将通过调整受孕时性别比或者通过给某一性别的后代额外的关心,来平衡亲代对两性后代的总投资。Fisher在书中举了一个例子:人类男性后代在亲代投资期间(比如受孕或哺乳期间)有较高的死亡率,这会导致成功性成熟的男性后代有较高的亲代投资,但是由于那些在亲代投资期间死亡的男性并没有得到全部的亲代投资,实际上每个出生的男性后代会有较低的平均亲代投资。因此,自然选择会提高出生性别比,生更多的男性,使得亲代对每个出生的男性后代的和女性后代的总投资相等。这个理论还引向了一个有趣的结论:如果两性在亲代投资期结束后具有不同的死亡率,这种死亡率的差异并不会对性别比产生任何影响。我在前一段落中对死亡率的分析其实就体现了该理论框架中的一个特例:当亲代投资期的长度为0时,两性不同的死亡率永远在亲代投资期之外,因此对出生性别比完全没有影响。
Fisher认为亲代投资理论能够解释自然界中偏离1的性别比,而人类出生时与受孕时略高于1的性别比(当时人们认为受孕时性别比也略高于1)主要是由在亲本投资期间较高的男性死亡率导致的。然而有研究推测人类受孕时的性别比应该非常接近1 (Orzack et al., 2015),那么是否有其他因素能够影响出生时与受孕时的性别比呢?
Daniela Sieff非常全面地总结了在演化层面上能够解释性别比的理论 (Sieff et al., 1990),在此将其中的一些解释列出:
- 营养状况影响后代性别
Trivers和Willard提出,营养状况可以通过两种不同的方式影响性别比(Trivers & Willard, 1973)。第一,亲代的营养情况对两性后代的适应度有不同的影响。比如,对于一夫多妻制的动物,包括人类,男性之间适应度的差异比女性大——社会地位较高(营养条件较好)的家庭中的男性比同等社会地位的女性有更多的后代,而社会地位较低的男性大多没有后代。这导致的自然选择的结果是,为了尽可能多地留下后代,社会地位高的家庭倾向于生育更多的男性,而社会地位低的家庭倾向于生育更多的女性。第二点是营养状况会影响亲代投资。比如,在一夫多妻制的动物中,生育男性的投资一般比生育女性的投资要大(Clutton-Brock et al., 1982):只有营养状况好的女性才有比较高的成功率生育多个男性后代。因此,营养状态差的女性会较多地生育女性后代,拉低性别比,而在低性别比的情况下,男性有更多的机会留下后代,所以营养状况好的女性会倾向于生育更多的男性后代,拉高性别比。
- 杀婴(infanticide)
Maynard Smith 提出,如果一个后代的性别是可以由亲代决定的,那么从演化的角度上来说,最好的策略是以一定的比例抛弃需要较少亲代投资的性别,(Smith, 1980)。然而这种行为只有在某性别的亲代投资非常小时才能带来好处。但是感觉人类社会的杀婴行为(弃婴,人工流产等等)大多是由于男权社会(patriarchal society)的思想造成的,而且人类的男女后代的亲代投资并没有太大差别,这种偏向性的杀婴行为的结果也并不会增加后代数量。此外,杀婴现象虽然还存在,但是在比较发达的地区应该是小概率事件了。如果1.05的性别比完全由杀婴现象导致,这意味着每诞生21个女性后代就有一个女性后代被故意杀死,感觉不太可能,因此杀婴还是不能完全解释现代人类群体中偏高的性别比。
- 亲缘间的竞争与合作 (kin selection)
Hamilton和Clark提出,亲代投资也会被后代之间,后代与亲代之间的竞争与合作所影响 (Clark, 1978; Hamilton, 1967)。假如在男性后代之间有更多的竞争,那么对男性后代的亲代投资会随着男性后代的数量而增加,因此亲代将选择生育较少的男性后代。而如果男性后代会对其亲属提供帮助,那么对男性后代的亲代投资会比较低,因此亲代将选择生育较多的男性后代。对于人类来说,有报道称女性后代能够更多地帮助照顾其兄弟姐妹,而如果前几个出生的是女性后代,亲代将有更高的生育率 (Betzig et al., 1988),而男性后代能够为家庭提供更多的食物资源 (Hill & Kaplan, 1988)。
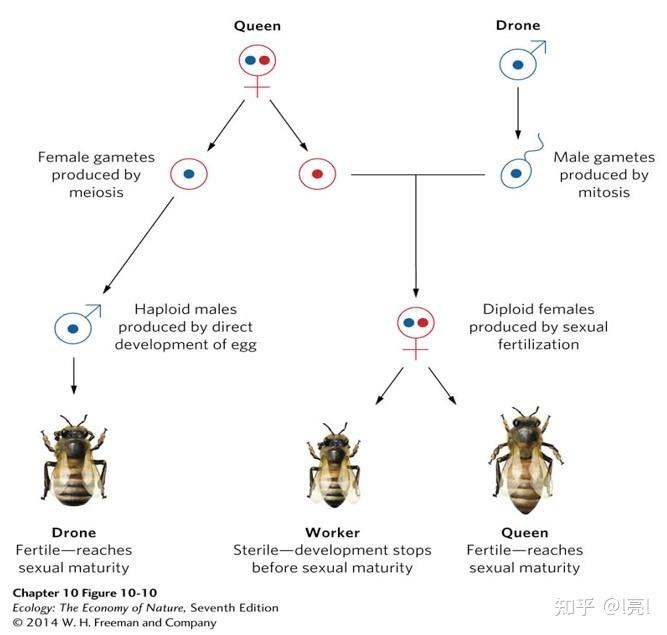
另外一个经典的有意思的例子是真社会性(eusocial)昆虫的性别比。真社会性膜翅目昆虫,比如蚂蚁,往往有一个或几个雌性的蚁后,众多的雌性工蚁,和繁殖季节婚飞的雄性公蚁,这导致雌性数量远超雄性,性别比严重地偏低,而这一般就是由亲缘选择(kin selection)解释的——因为产生的工蚁能够帮助养育更多的姐妹。既然这里那就再说一句题外话,真社会性膜翅目昆虫性别比的成因还受到很多其他因素的影响,比如不同性别后代继承的父亲与母亲基因的比例,在这一点上真社会性膜翅目昆虫是特殊的,因为蚁后和工蚁是双倍体,而公蚁是单倍体,这导致了蚁后与它的雌性后代和雄性后代之间都共享有50%的基因,而作为工具人的雌性工蚁对其他姐妹(其他工蚁和蚁后)共享有75%的基因,而对其兄弟公蚁只共享有50%的基因,而公蚁的基因100%会遗传给雌性后代,但只有50%的可能性遗传给雄性后代。所以我们看到不同的阶级有不同的利益诉求:蚁后想要两性平等,而工蚁与公蚁都希望有更多的姐妹/雌性后代。更有意思的是,各个阶级的个体可以通过自己的行为来调整性别比,比如工蚁因此会对雌性幼体关爱有加,而对公蚁的幼体照顾的不那么周到,而蚁后也会将计就计,上调公蚁的出生比例以力求两性平等 (Helantera & Ratnieks, 2009)。
膜翅目真社会性昆虫的性别系统
回到正题,除了Daniela Sieff总结的这几条外,我认为生命周期的一些特征,尤其是两性不同的生育的年龄,对性别比可能也有很大的影响。对于人类来说,母亲的年龄往往比父亲要小,这意味着女性通常有比较短的生育周期,因此当群体在快速扩张时会有比较高的适应度。我们知道人类群体在过去的十几万年走出非洲的过程中经历了快速的人口扩张,考虑到女性较短的生育周期,这可能会造成偏低的性别比。
一个对复杂综合的人口模型的模拟显示,性别比由很多因素决定,甚至亲代投资结束后的死亡率也能影响受孕时的性别比 (Shyu & Caswell, 2016)。我们可以看到,影响人类性别比的因素多样而复杂,性别比没有任何理由会在生命周期的任何一个时间点上等于1,而我们看到的约为1.05的出生性别比应该是多种因素结合的结果。
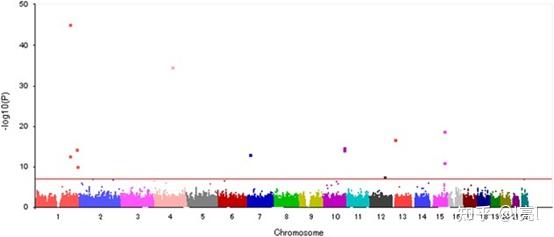
另一个重要的一点是性别比的遗传度(inheritability)。如果性别比并不受基因调控,不能被遗传,那么上面所有的讨论都将是扯淡。有趣的是,对于性别比的遗传度,不同的研究提出的证据支持了不同的结论。一般来说,人们是相信性别比是可以遗传的 (Curtsinger et al., 1983; Gellatly, 2008; Trichopoulos, 1967),而最近的一篇基于韩国人群的GWAS文章也显示基因组中有9个位点与后代的性别有显著的相关性 (Ryu et al., 2016)。然而,另一些研究显示,人类性别比主要由环境因素决定,而不是亲代基于环境因素所作出的反应,并不能为性别比的遗传性提供证据 (Catalano et al., 2020)。此外,一个大尺度的研究,通过瑞典的470万个出生记录计算性别比的遗传度,没有检测到性别比任何的遗传度 (Zietsch et al., 2020)。个人觉得,性别比应该还是有基因基础的。
Ryu et al., 2016 中影响性别比的等位基因
看起来对于人类偏高的出生性别比的问题没有一个简单的答案。对两性后代不同的亲代投资,不同的营养状况的影响,与亲属之间的竞争与合作,以及环境因素等,共同造就了当前人类群体1.05左右的出生性别比。
==Reference==
Austad, S. N. (2011). Chapter 23 - Sex Differences in Longevity and Aging. In E. J. Masoro & S. N. Austad (Eds.),==Handbook of the Biology of Aging (Seventh Edition)==(pp. 479-495). Academic Press.==https://doi.org/https://doi.org/10.1016/B978-0-12-378638-8.00023-3==
Betzig, L., Mulder, M. B., & Turke, P. (1988).==Human reproductive behaviour: A Darwinian perspective==. CUP Archive.
Catalano, R., Casey, J. A., & Bruckner, T. A. (2020). A test of oscillation in the human secondary sex ratio.==Evol Med Public Health==,==2020==(1), 225-233.==https://doi.org/10.1093/emph/eoaa012==
Clark, A. B. (1978). Sex ratio and local resource competition in a prosimian primate.==Science==,==201==(4351), 163-165.==https://doi.org/10.1126/science.201.4351.163==
Clutton-Brock, T. H., Guinness, F. E., & Albon, S. D. (1982).==Red deer: behavior and ecology of two sexes==. University of Chicago press.
Curtsinger, J., Ito, R., & Hiraizumi, Y. (1983). A two-generation study of human sex-ratio variation.==American journal of human genetics==,==35==(5), 951.
Dupanloup, I., Pereira, L., Bertorelle, G., Calafell, F., Prata, M. J., Amorim, A., & Barbujani, G. (2003). A recent shift from polygyny to monogamy in humans is suggested by the analysis of worldwide Y-chromosome diversity.==J Mol Evol==,==57==(1), 85-97.==https://doi.org/10.1007/s00239-003-2458-x==
Eshel, I. (1975). Selection of sex-ratio and the evolution of sex-determination.==Heredity (Edinb)==,==34==(3), 351-361.==https://doi.org/10.1038/hdy.1975.44==
Fisher, R. A. (1958).==The genetical theory of natural selection==. Рипол Классик.
Gellatly, C. (2008). Trends in Population Sex Ratios May be Explained by Changes in the Frequencies of Polymorphic Alleles of a Sex Ratio Gene.==Evolutionary Biology==,==36==(2), 190-200.==https://doi.org/10.1007/s11692-008-9046-3==
Hamilton, W. D. (1967). Extraordinary sex ratios.==Science==,==156==(3774), 477-488.
Helantera, H., & Ratnieks, F. L. (2009). Sex allocation conflict in insect societies: who wins?==Biol Lett==,==5==(5), 700-704.==https://doi.org/10.1098/rsbl.2009.0501==
Hill, K., & Kaplan, H. (1988). Tradeoffs in male and female reproductive strategies among the Ache: Part 1.==Human reproductive behavior==, 277-290.
Jacobsen, R., Moller, H., & Mouritsen, A. (1999). Natural variation in the human sex ratio.==Hum Reprod==,==14==(12), 3120-3125.==https://doi.org/10.1093/humrep/14.12.3120==
Orzack, S. H., Stubblefield, J. W., Akmaev, V. R., Colls, P., Munne, S., Scholl, T., Steinsaltz, D., & Zuckerman, J. E. (2015). The human sex ratio from conception to birth.==Proc Natl Acad Sci U S A==,==112==(16), E2102-2111.==https://doi.org/10.1073/pnas.1416546112==
Patton, G. C., Coffey, C., Sawyer, S. M., Viner, R. M., Haller, D. M., Bose, K., Vos, T., Ferguson, J., & Mathers, C. D. (2009). Global patterns of mortality in young people: a systematic analysis of population health data.==The Lancet==,==374==(9693), 881-892.==https://doi.org/10.1016/s0140-6736(09)60741-8==
Rajaratnam, J. K., Marcus, J. R., Levin-Rector, A., Chalupka, A. N., Wang, H., Dwyer, L., Costa, M., Lopez, A. D., & Murray, C. J. L. (2010). Worldwide mortality in men and women aged 15–59 years from 1970 to 2010: a systematic analysis.==The Lancet==,==375==(9727), 1704-1720.==https://doi.org/10.1016/s0140-6736(10)60517-x==
Ryu, D., Ryu, J., & Lee, C. (2016). Genome-wide association study reveals sex-specific selection signals against autosomal nucleotide variants.==J Hum Genet==,==61==(5), 423-426.==https://doi.org/10.1038/jhg.2015.169==
Shyu, E., & Caswell, H. (2016). A demographic model for sex ratio evolution and the effects of sex-biased offspring costs.==Ecol Evol==,==6==(5), 1470-1492.==https://doi.org/10.1002/ece3.1902==
Sieff, D. F., Betzig, L., Cronk, L., Fix, A. G., Flinn, M., Sattenspiel, L., Gibson, K., Herring, D. A., Howell, N., Johansson, S. R., Pavlík, Z., Sheets, J. W., Smith, E. A., Voland, E., & Siegelkow, E. (1990). Explaining Biased Sex Ratios in Human Populations: A Critique of Recent Studies [and Comments and Reply].==Current Anthropology==,==31==(1), 25-48.==https://doi.org/10.1086/203801==
Smith, J. M. (1980). A new theory of sexual investment.==Behavioral Ecology and Sociobiology==,==7==(3), 247-251.==https://doi.org/10.1007/bf00299371==
Trichopoulos, D. (1967). Evidence of genetic variation in the human sex ratio.==Human Biology==, 170-175.
Trivers, R. L. (1972). Parental investment and sexual selection. In ‘Sexual Selection and the Descent of Man’.(Ed. B. Campbell.) pp. 136–179.==Aldinc: Chicago==,==13==(2).
Trivers, R. L., & Willard, D. E. (1973). Natural selection of parental ability to vary the sex ratio of offspring.==Science==,==179==(4068), 90-92.==https://doi.org/10.1126/science.179.4068.90==
Zietsch, B. P., Walum, H., Lichtenstein, P., Verweij, K. J. H., & Kuja-Halkola, R. (2020). No genetic contribution to variation in human offspring sex ratio: a total population study of 4.7 million births.==Proc Biol Sci==,==287==(1921), 20192849.==https://doi.org/10.1098/rspb.2019.2849==